§ 3. Химическая связь
1. Какие вещества существуют в форме свободных атомов? Объясните причину такого явления.
Благородные газы (элементы VIIIA‑группы) существуют в форме свободных атомов, чьи простые вещества состоят из одноатомных молекул. Причина: У атомов этих элементов на внешнем энергетическом уровне находится максимально возможное число электронов (2 у гелия и по 8 у остальных). Такой энергетический уровень называется завершенным и считается самым устойчивым, поэтому они не стремятся к образованию соединений.
2. Почему большинство атомов в природе существует в виде различных соединений?
У большинства атомов внешние энергетические уровни незавершены; стремясь завершить их (приобрести электронное строение ближайшего благородного газа), атомы вступают в химическое взаимодействие и образуют соединения.
3. Что представляет собой химическая связь? Каковы ее природа и условия образования?
Химическая связь — это взаимодействие, связывающее отдельные атомы в более сложные системы (молекулы, атомные кристаллы и др.). Природа связи – электростатическая (притяжение разноимённых и отталкивание одноимённых зарядов). Связь образуется, когда атомы достигают более устойчивого электронного состояния; при этом всегда выделяется энергия.
4. Укажите основные типы химической связи. Что общего и каковы различия между ними?
Ковалентная, ионная, металлическая.
Общее: электростатическая природа; образование более устойчивого состояния; сопровождается выделением энергии.
Различия заключаются в способе достижения атомами устойчивого состояния: ковалентная связь возникает между атомами неметаллов в результате образования общих электронных пар; ионная связь образуется при значительном различии электроотрицательностей атомов за счет полного перехода электрона от одного атома к другому и последующего электростатического притяжения образовавшихся ионов; металлическая связь характерна для металлов и осуществляется за счет притяжения между положительно заряженными ионами металла и обобществленными электронами («электронным газом»).
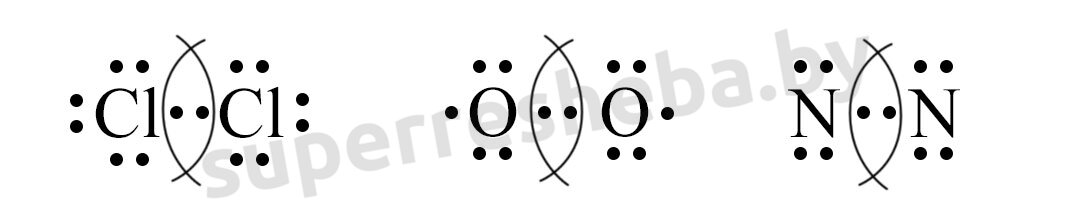
5. Дайте определение ковалентной связи. Составьте электронные схемы образования ковалентной связи в молекулах Сl2, О2 и N2.
Ковалентная связь — это связь, возникающая в результате образования общих электронных пар между двумя атомами.
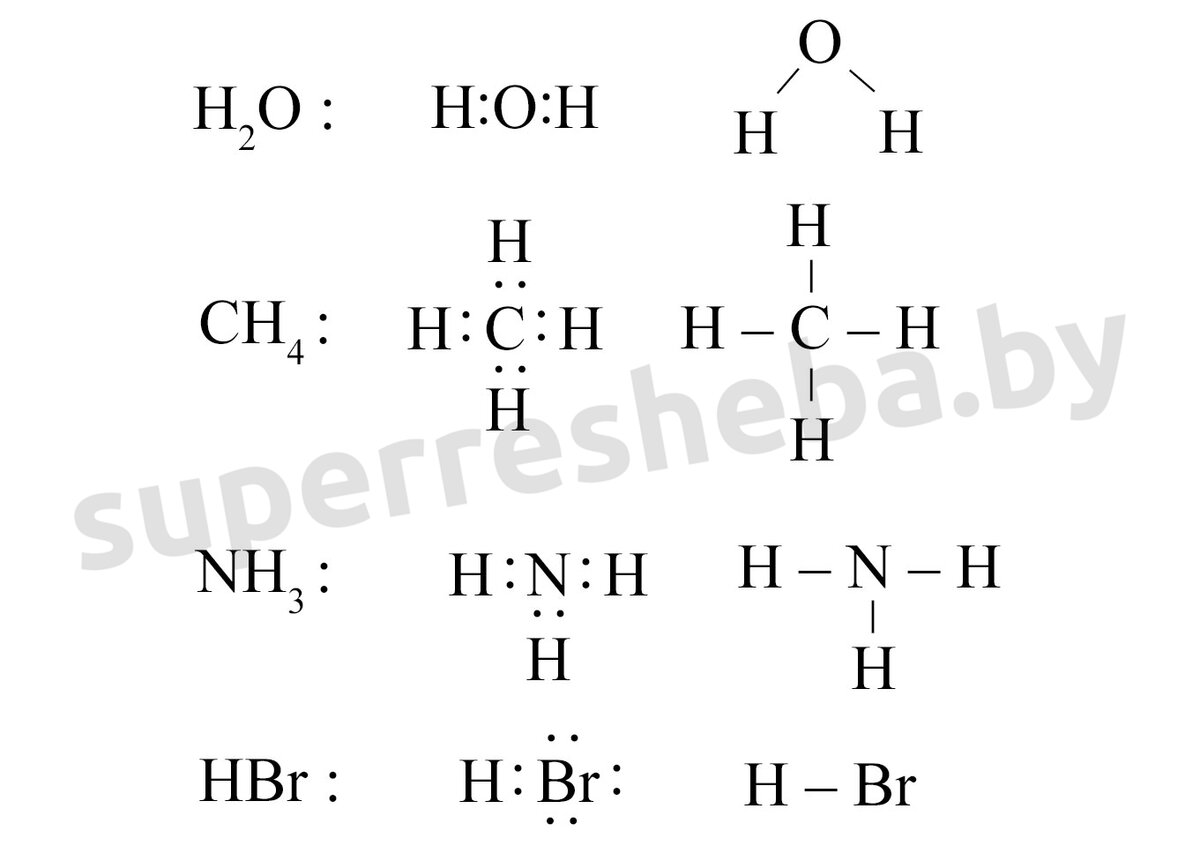
6. Изобразите электронные и структурные формулы молекул H2O, CH4, NH3, HBr.
7. Дайте определение ионной связи. Какие общие черты и какие различия имеются у ковалентной и ионной связи?
Ионная связь — это химическая связь, осуществляющаяся за счёт притяжения противоположно заряженных ионов; возникает при практически полном переходе электрона от атома металла к атому более электроотрицательного неметалла при значительной разности электроотрицательностей.
Общие черты: обе являются видами химической связи, имеют электростатическую природу, при их образовании выделяется энергия, способствуют достижению устойчивого (благородного) электронного состояния.
Различия
Способ образования: ковалентная – за счёт общих электронных пар; ионная – за счёт притяжения ионов после перехода электрона.
Распределение электронов: ковалентная может быть неполярной (у одинаковых атомов) или полярной (смещение пары к более электроотрицательному атому); при ионной связи имеет место практически полный перенос электрона.
Тип частиц и строение: ковалентная характерна для неметаллов и приводит к образованию молекул или атомных кристаллов; ионная даёт твёрдые вещества с ионной кристаллической решёткой, а формула отражает простейшее соотношение ионов.
8. Из предложенного перечня выберите формулы веществ с ионной, ковалентной полярной и ковалентной неполярной связью: BaCl2, H2S, N2, HBr, CO2, Cl2, NaI.
Ионная: BaCl2, NaI.
Ковалентная полярная: H2S, HBr, CO2.
Ковалентная неполярная: N2, Cl2.