4. Изобразите с помощью электронно-графических схем и формул электронных конфигураций основное и возбуждённое состояния атомов S и Сl. Укажите число неспаренных электронов в каждом случае. Почему атомы хлора чаще всего проявляют нечётные степени окисления, а атомы серы — чётные?
Для серы:
Основное состояние серы (2 неспаренных электрона).
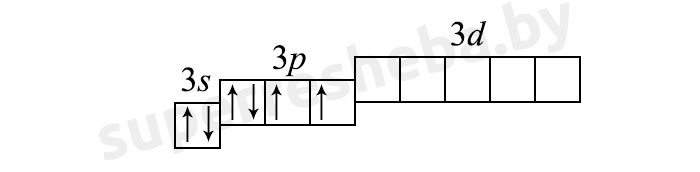
В возбуждённом состоянии электроны распариваются на d-подуровень:
1) (4 неспаренных электрона):
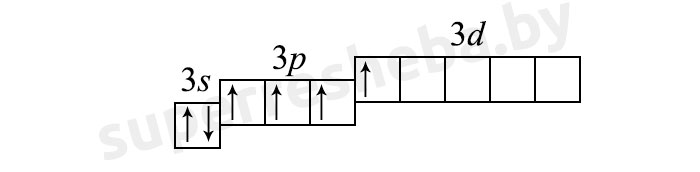
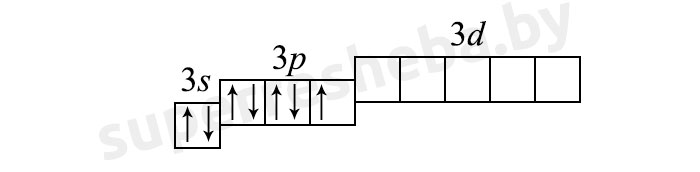
2) (6 неспаренных электрона):
Т.к. у серы четное количество неспаренных электронов, для неё более характерны четные степени окисления.
Для хлора:
(3 неспаренных электрона)
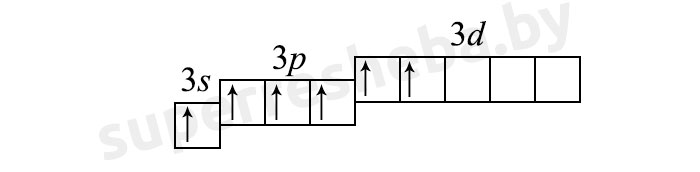
Основное состояние хора (1 неспаренный электрон)
В возбуждённом состоянии электроны распариваются на d-подуровень:
1) (3 неспаренных электрона):
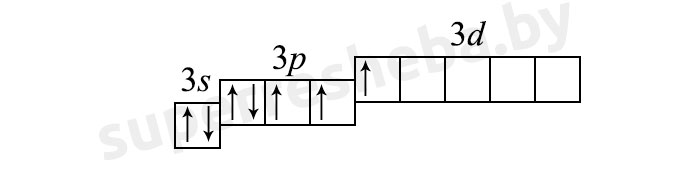
2) (5 неспаренных электрона):
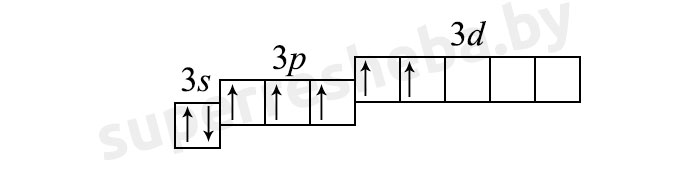
3) (7 неспаренных электрона):
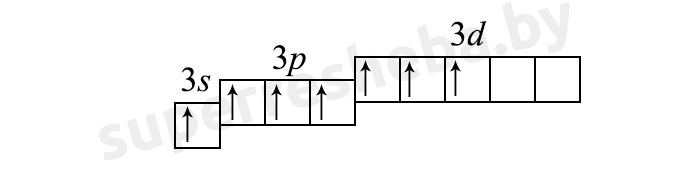
Т.к. у хлора нечётное количество неспаренных электронов, для него более характерны нечётные степени окисления.