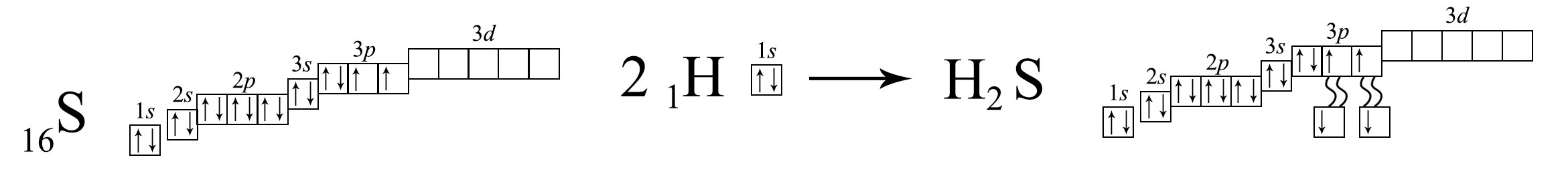4. Сравните электронные схемы и электронные конфигурации: а) атома Li и иона Li+ в бромиде лития; б) атома Сl и иона Сl‒ в хлориде калия; в) атома S и атома серы в молекуле сероводорода.
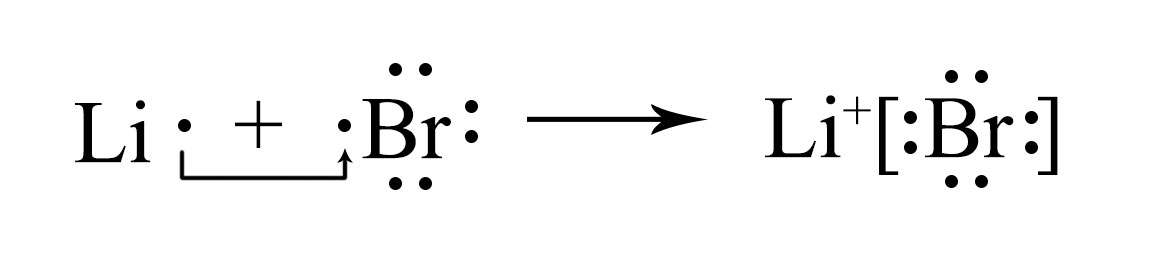
а) атома Li и иона LiX+ в бромиде лития
LiBr — бромид лития;
в бромиде лития атом лития превращается в катион лития:
X7X272Li1s22s1−e→X7X272LiX+1s2 (или Li−e→LiX+);
В сокращённом виде:
[He]2s1−e→[He] — катион лития LiX+ приобретает конфигурацию гелия;
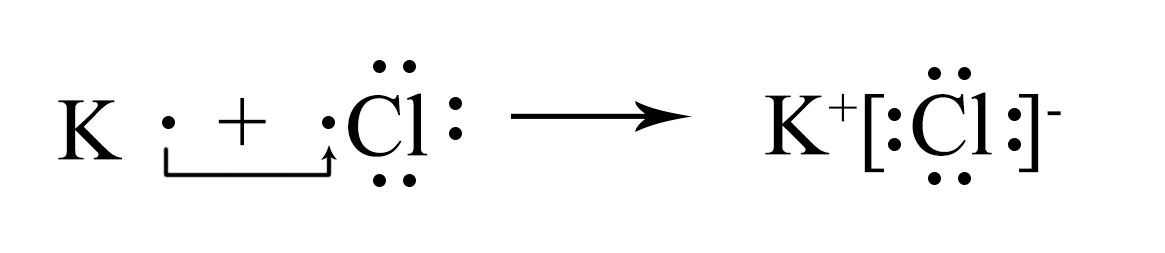
б) атома Сl и иона СlX− в хлориде калия
KCl — хлорид калия;
в хлориде калия хлор превращается в хлорид-ион:
X17X2172Cl1s22s22p63s23p5+e→X17X2172ClX−1s22s22p63s23p6 (или Cl+e→ClX−);
В сокращённом виде:
[He]3s23p5+e→[Ar] — хлорид-ион ClX− приобретает конфигурацию аргона;
в) атома S и атома серы в молекуле сероводорода
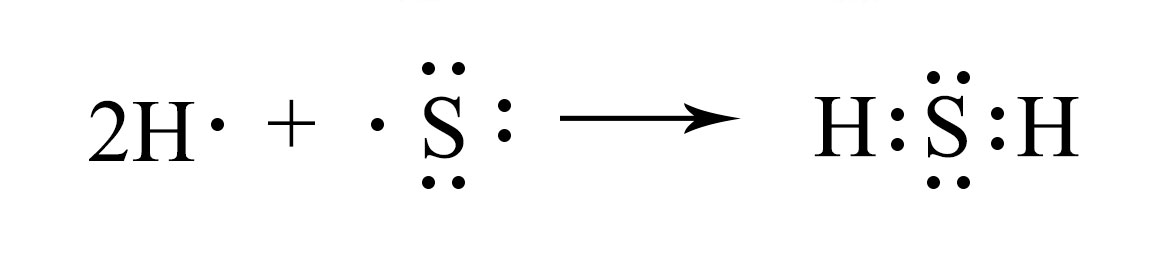
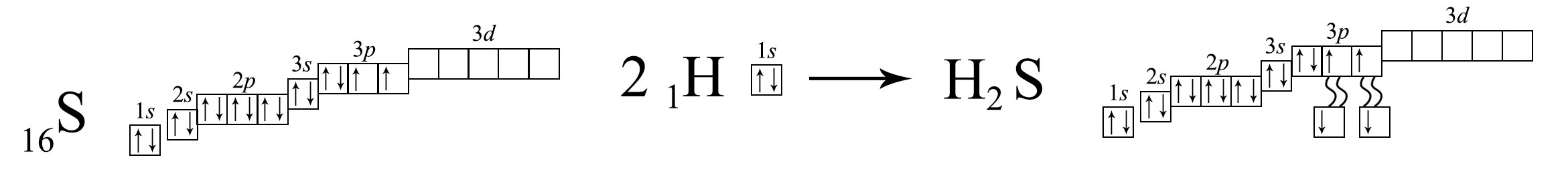
Атом серы в молекуле сероводорода приобретает конфигурацию аргона Ar1s22s22p63s23p6.