2. По приведённому в тексте параграфа плану составьте описание следующих химических элементов: а) сера; б) хлор; в) алюминий; г) натрий.
а) сера
1. Элемент сера имеет химический знак S, атомный номер Z = 16. Сера расположена в третьем периоде, малом, в VI A-группе, главной. Относительная атомная масса Ar(S) = 32.
2. Строение атома:
а) заряд ядра атома серы +16. В состав ядра атома серы входят 16 протонов. Самый распространённый в природе изотоп — это нуклид 32S. Число нейтронов в ядре этого нуклида равно 32 – 16 = 16;
б) электронная оболочка атомов серы содержит 16 электронов, которые распределены по трем энергетическим уровням; электронная схема: 16S 2e, 8e, 6e; формула электронной конфигурации: 16S 1s22s22p63s23p4; электронно-графическая схема:
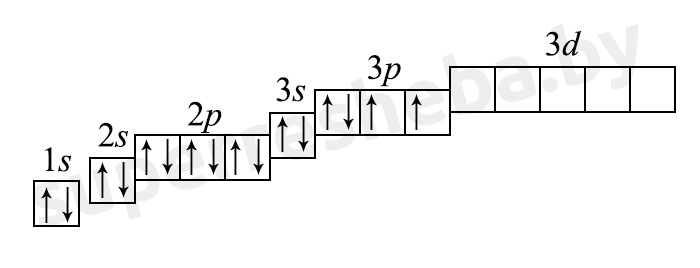
в) конфигурация внешнего электронного слоя: 3s23p4, значит, сера — р-элемент.
3. Степени окисления атомов элемента: высшая +6, так как на внешнем энергетическом уровне атома находится 6 электронов, низшая –2. Электроотрицательность: x(S) = 2.5. megaresheba.ru megareslieba.ru
4. Простое вещество азот является неметаллом, агрегатное состояние при н. у. — твердое, химическая формула S.
5. Формула высшего оксида S+6O3, оксид серы (VI), кислотный; формула гидроксида, соответствующего высшему оксиду, H2S+6O4, гидроксид кислотный, серная кислота; водородное соединение H2S-2, летучее, так как сера является неметаллом.
б) хлор
1. Элемент хлор имеет химический знак Cl, атомный номер Z = 17. Хлор расположен в третьем периоде, малом, в VII A-группе, главной. Относительная атомная масса Ar(Сl) = 35.5.
2. Строение атома:
а) заряд ядра атома хлора +17. В состав ядра атома хлора входят 17 протонов. Самый распространённый в природе изотоп — это нуклид 35Cl. Число нейтронов в ядре этого нуклида равно 35 – 17 = 18.
б) электронная оболочка атомов содержит 17 электронов, которые распределены по трем энергетическим уровням; электронная схема: 17Cl 2e, 8e, 7e; формула электронной конфигурации: 17Cl 1s22s22p63s23p5; электронно-графическая схема:
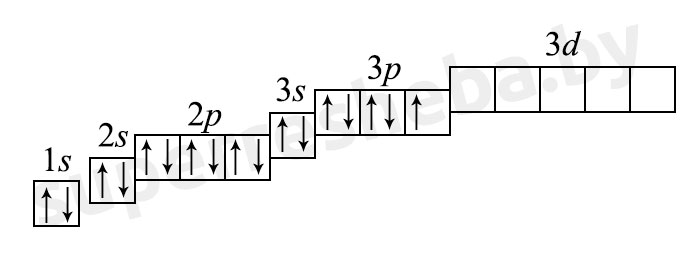
в) конфигурация внешнего электронного слоя: 3s23p5, значит, хлор — р-элемент.
3. Степени окисления атомов элемента: высшая +7, так как на внешнем энергетическом уровне атома находится 7 электронов, низшая –1. Электроотрицательность: х(Сl) = 3.0.
4. Простое вещество хлор является неметаллом, агрегатное состояние при н. у. — газ, химическая формула Cl2.
5. Формула высшего оксида Cl+72O7, оксид серы (VII), кислотный; формула гидроксида, соответствующего высшему оксиду, HCl+7O4, гидроксид кислотный, хлорная кислота; водородное соединение HCl-1, летучее, так как хлор является неметаллом.
в) алюминий
1. Элемент алюминий имеет химический знак Al, атомный номер Z = 13. Алюминий расположен в третьем периоде, малом, в III A-группе, главной. Относительная атомная масса Ar(Al) = 27.
2. Строение атома:
а) заряд ядра атома алюминия +13. В состав ядра атома входят 13 протонов. Единственный в природе изотоп — это нуклид 27Al. Число нейтронов в ядре этого нуклида равно 27 – 13 = 14.
б) электронная оболочка атомов содержит 13 электронов, которые распределены по трем энергетическим уровням; электронная схема: 13Al 2e, 8e, 3e; формула электронной конфигурации: 13Al 1s22s22p63s23p1; электронно-графическая схема:
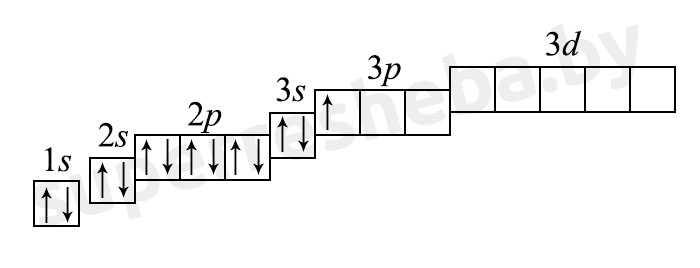
в) конфигурация внешнего электронного слоя: 3s23p1, значит, алюминий — р-элемент.
3. Степени окисления атомов элемента: высшая +3, так как на внешнем энергетическом уровне атома находится 3 электронов, низшая 0. Электроотрицательность: х(Al) = 1.5.
4. Простое вещество алюминий является металлом, агрегатное состояние при н. у. —твердое, химическая формула Al.
5. Формула высшего оксида Al+32O3, оксид алюминия, амфотерный; формула гидроксида, соответствующего высшему оксиду, Al(OH)3, гидроксид алюминия, амфотерный; водородное соединение Al-3H3, нелетучее, так как алюминий является метал.
г) натрий
1. Элемент натрий имеет химический знак Na, атомный номер Z = 11. Натрий расположен в третьем периоде, малом, в I A-группе, главной. Относительная атомная масса Ar(Na) = 23.
2. Строение aтома:
а) заряд ядра атома натрия +11. В состав ядра атома входят 11 протонов. Самый распространённый в природе изотоп — это нуклид 23Na. Число нейтронов в ядре этого нуклида равно 23 – 11 = 12.
б) электронная оболочка атомов содержит 11 электронов, которые распределены по трем энергетическим уровням; электронная схема: 11Na 2e, 8e, 1e; формула электронной конфигурации: 11Na 1s22s22p63s1; электронно-графическая схема:
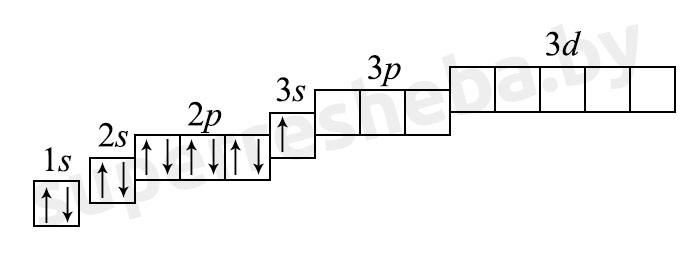
в) конфигурация внешнего электронного слоя: 3s1, значит, натрий — s-элемент.
3. Степени окисления атомов элемента: высшая +1, так как на внешнем энергетическом уровне атома находится 1 электронов, низшая 0. Электроотрицательность: x(Na) = 0.9.
4. Простое вещество натрий является металлом, агрегатное состояние при н. у. — твердое, химическая формула Na.
5. Формула высшего оксида Na+12O, оксид натрия, основный; формула гидроксида, соответствующего высшему оксиду, NaOH, гидроксид натрия, основный (щелочь), водородное соединение Al-3H3 нелетучее, гак как алюминий является металлом.