§ 3. Органические вещества. Аминокислоты. Белки
1. Какие из представленных веществ являются биологическими полимерами? Какие вещества являются мономерами для построения молекул биополимеров? Аминокислоты, нуклеиновые кислоты, полисахариды, нуклеотиды, белки, моносахариды.
Биологические полимеры: нуклеиновые кислоты, полисахариды, белки.
Мономеры для построения молекул биополимеров: аминокислоты, нуклеотиды, моносахариды.
2. Какие функциональные группы характерны для всех аминокислот? Какими свойствами обладают эти группы?
Для всех аминокислот характерны аминогруппа (—NН2), обладающая основными свойствами, и карбоксильная группа (—СООН), проявляющая кислотные свойства.
3. Сколько аминокислот участвует в образовании природных белков? Назовите общие черты строения этих аминокислот. Чем они различаются?
В образовании природных белков участвуют 20 аминокислот.
В молекулах белокобразующих аминокислот аминогруппа и карбоксильная группа присоединены к одному и тому же атому углерода. С этим же атомом углерода связан радикал (R), который у каждой аминокислоты имеет особое строение и определяет ее специфические свойства.
4. Как происходит соединение аминокислот в полипептидную цепь?
Карбоксильная группа (—СООН) одной аминокислоты может взаимодействовать с аминогруппой (—NH2) другой аминокислоты. При этом от карбоксильной группы отщепляется группа —ОН, а от аминогруппы — атом водорода. В результате выделяется молекула воды, а между атомом углерода карбоксильной группы и атомом азота аминогруппы возникает ковалентная связь, которая называется пептидной связью. Так образуется дипептид, который имеет на одном конце свободную аминогруппу, а на другом — свободную карбоксильную группу. Благодаря любой из них дипептид может взаимодействовать со следующей аминокислотой, образуя трипептид и т. д. Если таким образом соединяется более 10 остатков аминокислот, то образуется полипептид.
5. Охарактеризуйте уровни структурной организации белков. Какие химические связи обусловливают существование и стабильность первичной, вторичной, третичной и четвертичной структур белков?
Различают четыре основных уровня организации белковых молекул — первичную, вторичную, третичную и четвертичную структуры.
Первичная структура белка — это строго определенная последовательность аминокислотных остатков в линейной полипептидной цепи. Каждый белок обладает уникальной первичной структурой. Ее существование обусловлено наличием прочных пептидных связей между остатками аминокислот.
Вторичная структура белка формируется за счет образования многочисленных водородных связей между атомами водорода NH-групп и атомами кислорода CO-групп разных аминокислотных остатков. Несмотря на то что эти связи слабее ковалентных, их количество обеспечивает стабильность вторичной структуры.
Формирование третичной структуры обеспечивают водородные, ионные и другие связи, возникающие между разными группами атомов белковой молекулы. У многих белков в образовании третичной структуры участвуют ковалентные дисульфидные связи (S—S связи), которые возникают между остатками аминокислоты цистеина.
Молекулы, входящие в состав четвертичной структуры белка, удерживаются вместе благодаря различным видам нековалентных связей — водородным, ионным, гидрофобным взаимодействиям и др.
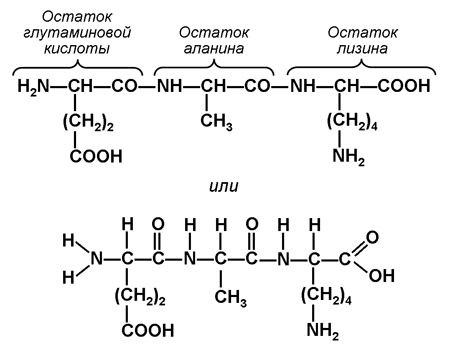
6. Постройте дипептид, имеющий структуру Лиз — Ала, и трипептид Глу — Ала — Лиз. Рассчитайте молекулярные массы этих пептидов. Для выполнения задания используйте структурные формулы аминокислот, показанные на рисунке 6.
Дипептид Лиз — Ала
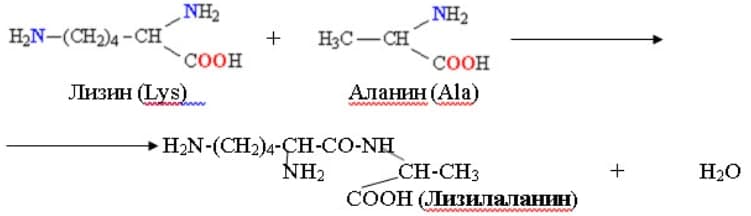
Трипептид Глу — Ала — Лиз
7. Для разделения смеси белков на компоненты используется метод электрофореза: в геле определенной плотности под действием электрического поля различные белковые молекулы перемещаются с разными скоростями. В результате этого одинаковые молекулы концентрируются в определенном участке геля. Как вы думаете, почему так происходит?
Скорость миграции пропорциональна заряду молекулы, и в свободной жидкости молекулы с одинаковым удельным зарядом мигрируют с равной скоростью. В случае разделения в среде, имеющей жесткую пространственную матрицу, происходит разделение за счет трения о гель. Сила трения зависит от пространственной конфигурации молекулы, в том числе от её размера.