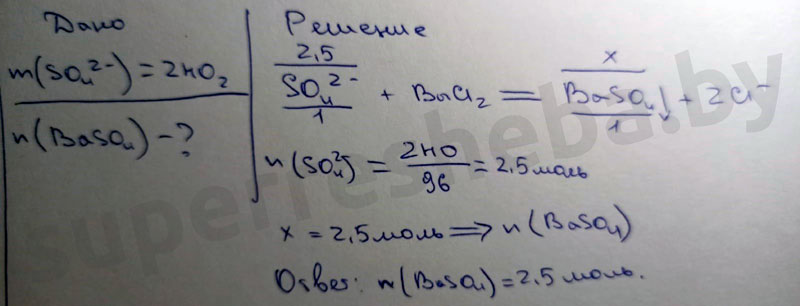Лаб. 3
1.
Раствор вещества – серная кислота
Реактив – хлорид бария
На рисунке:
левая пробирка – H2SO4
верхняя пробирка – BaCl2
правая пробирка – BaSO4
Признак реакции: выпадение белого осадка сульфата бария.
Раствор вещества – сульфат натрия
Реактив – хлорид бария
На рисунке:
левая пробирка – Na2SO4
верхняя пробирка – BaCl2
правая пробирка – BaSO4
Признак реакции: выпадение белого осадка сульфата бария.
2.
а)

б)

Вывод
Обнаружить сульфат-ионы в растворах можно при помощи хлорида бария – это качественная реакция на сульфат-ионы. Выпадение белого осадка обусловлено связыванием ионов бария с сульфат-ионами, которые вместе образуют нерастворимый осадок.
Задания
1. SO42-
2.
SO42- , SO32- , S2-.
3.
в) в электрическом поле перемещается к катоду
4.
Заряд 2- обусловлен тем, что серная кислота потеряла 2 водорода – 2 катиона – 2 частицы с зарядом +, превращаясь в сульфат ион. В сульфат-ионе 48 протонов и 50 электронов.
5.