Практ. 7
1.
Вариант 1
3
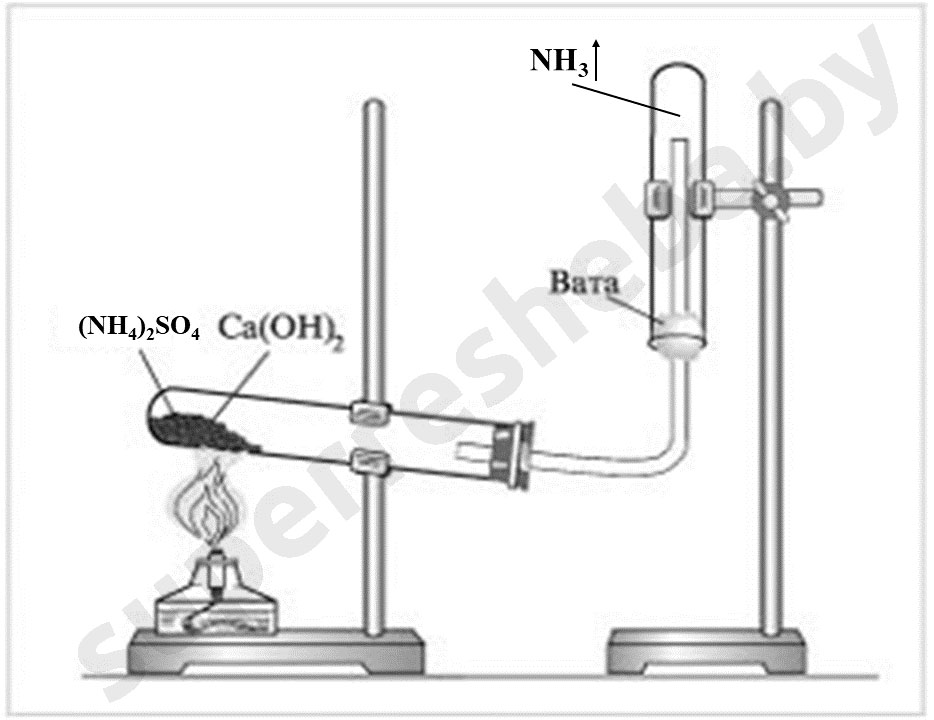
Уравнения реакций получения и обнаружения аммиака:
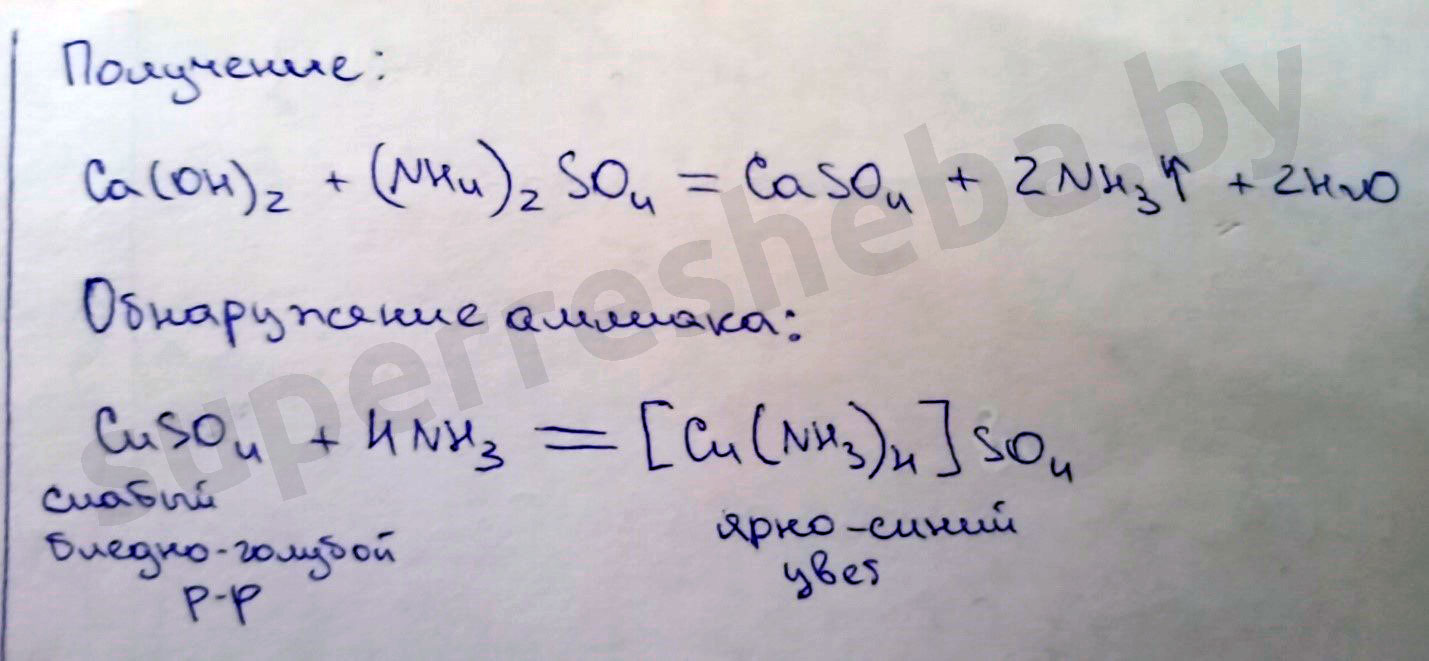
Вывод:
Были использованы гидроксид кальция и сульфат аммония, т.к. в ходе реакции при нагревании они дают аммиак. Для доказательства наличия аммиака мы выбрали сульфат меди (II), потому что на фоне слабо-голубого раствора сульфата очень хорошо видно ярко-синее окрашивание раствора комплексом рядом с газоотводной трубкой.
Вариант 2
6.
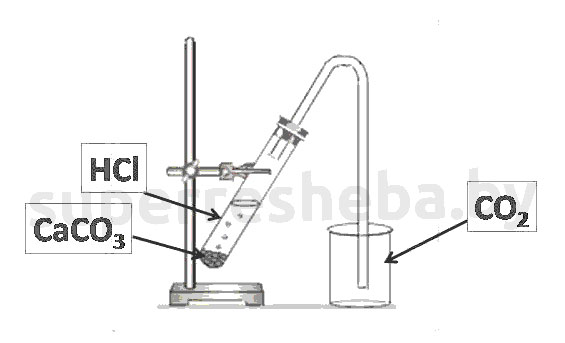
Уравнения реакций получения и обнаружения углекислого газа:
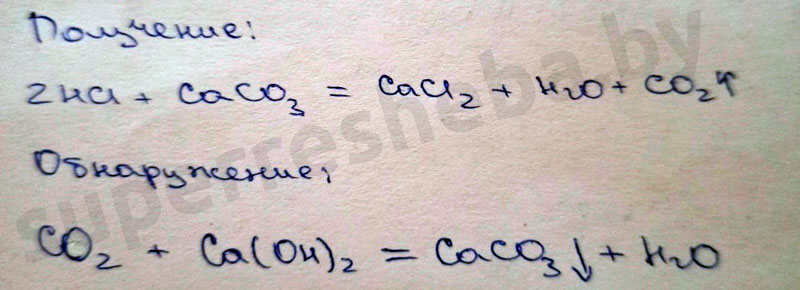
Вывод:
Из всех веществ только карбонат кальция мог давать углекислый газ, а для этого используется кислота, например соляная. Для обнаружения углекислого газа мы осуществили качественную реакцию на углекислый газ – реакция, пропуская углекислого газа через раствор гидроксида кальция, в котором образуется осадок карбоната кальция.
2. Подтвердите экспериментально качественный состав хлорида бария.
Вариант 1
1.
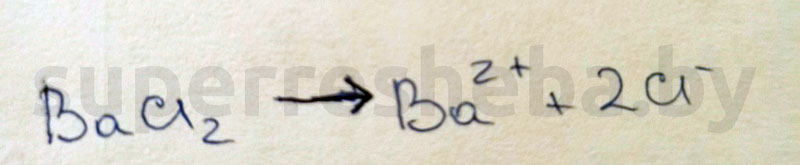
2.
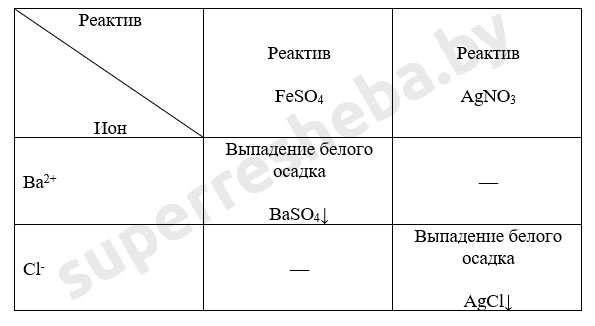
Уравнения реакций в молекулярном и ионном виде:
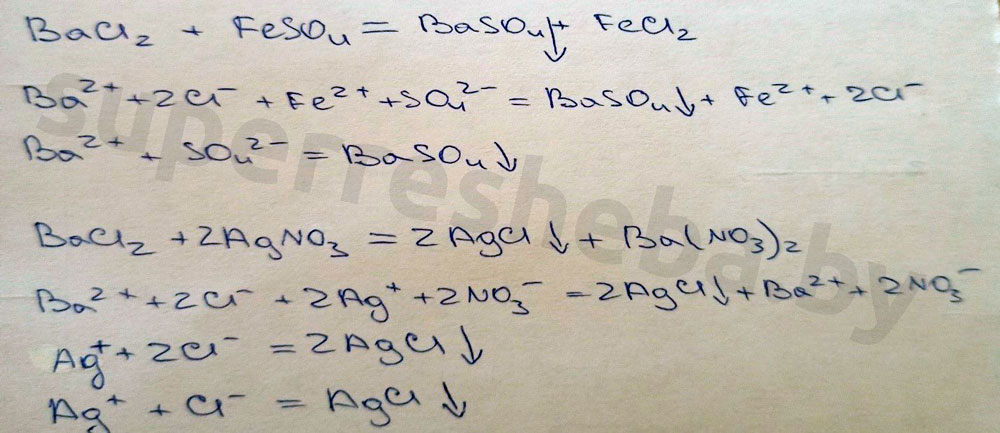
Вывод:
Был выбран сульфат железа (II), т.к. в ходе реакции выпадает осадок гидроксида бария – это качественная реакция на ионы бария. Также можно было взять сульфат меди (II). А реакция с нитратом серебра (I) – это качественная реакция на хлорид-ионы, которые входят в состав хлорида бария.
Вариант 2
1.

2.
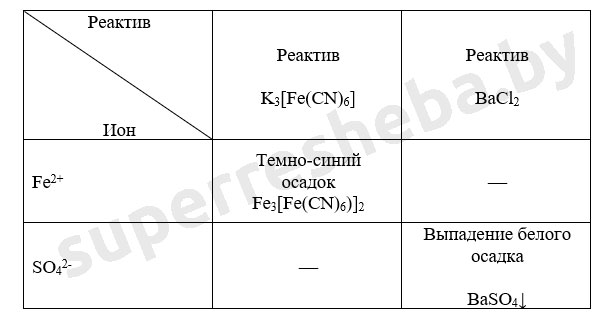
Уравнения реакций в молекулярном и ионном виде:
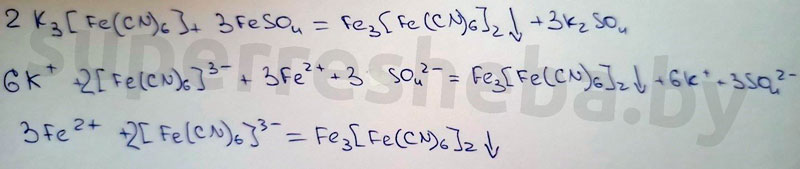
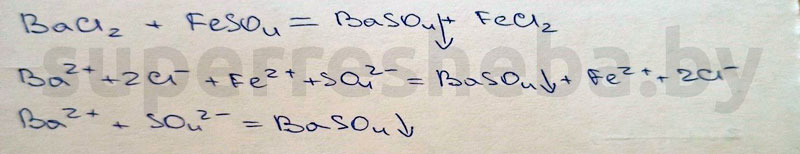
Вывод:
Был выбран хлорид бария, т.к. в ходе реакции выпадает осадок гидроксида бария. Реакция с гексацианоферратом (III) калия – это качественная реакция на ионы железа
3.
Вариант 1
1. Получение гидроксида алюминия.
Реактивы: хлорид алюминия и гидроксид натрия
Признаки химической реакции: выпадение белого студенистого осадка
Уравнение химической реакции:
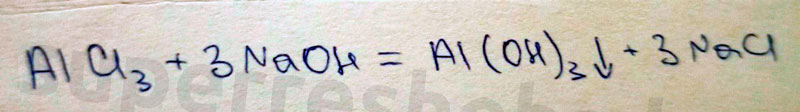
2. Получение гексагидроксоалюмината натрия.
Реактивы: гидроксид алюминия и гидроксид натрия
Признаки химической реакции: растворение белого студенистого осадка
Уравнение химической реакции:
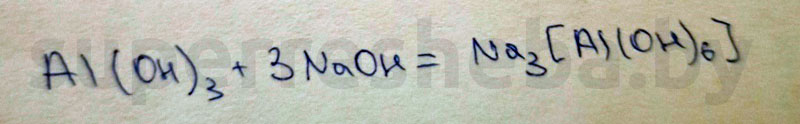
Вывод:
Мы выбрали гидроксид натрия, потому что он может осуществить оба наших превращения. Понемногу добавляя его, мы получим гидроксид алюминия, а добавив больше, мы растворим полученный осадок с образованием гексагидроксоалюмината натрия.
Вариант 2
3. Получение гидроксида меди (II).
Реактивы: сульфат меди (II) гидроксид натрия
Признаки химической реакции: выпадение василькового осадка
Уравнение химической реакции:
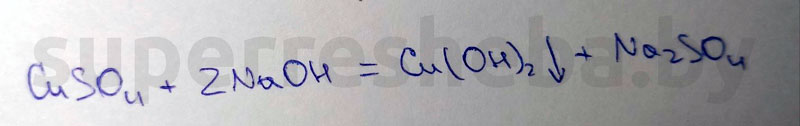
4. Получение оксида меди (II).
Реактивы: гидроксид меди (II)
Признаки химической реакции: испарение воды
Уравнение химической реакции:
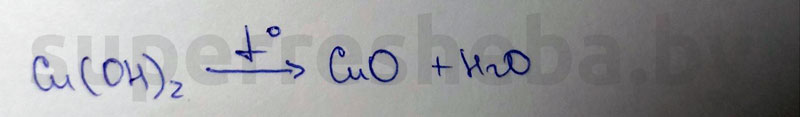
Вывод:
Для получения гидроксида меди (II), гидроксид натрия идеально подойдет, т.к. это хорошо растворимая в воде щелочь. А вот для второй реакции нам не нужен дополнительный реактив, потому что температурное разложение гидроксида меди (II) – это самый оптимальный вариант получения оксида меди (II).