Лаб. 2
1. Влияние концентрации кислоты на скорость химической реакции.
1.
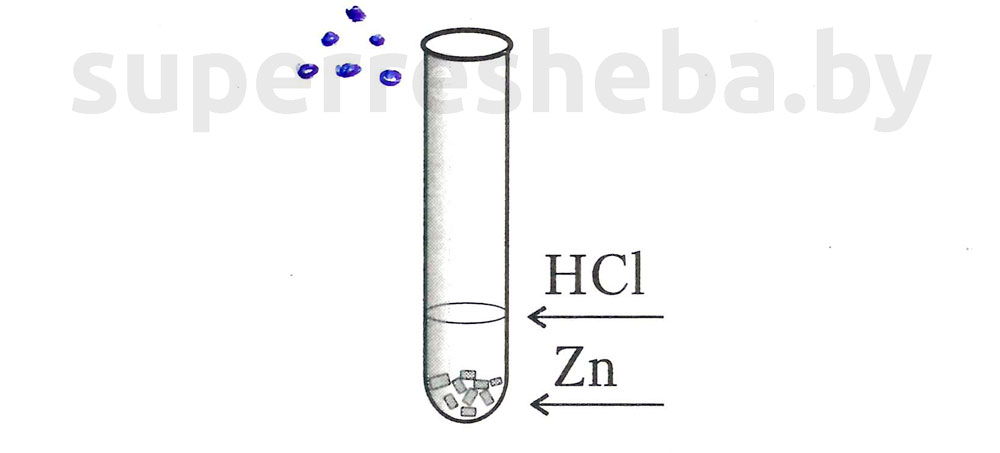
Уравнение химической реакции:
2.
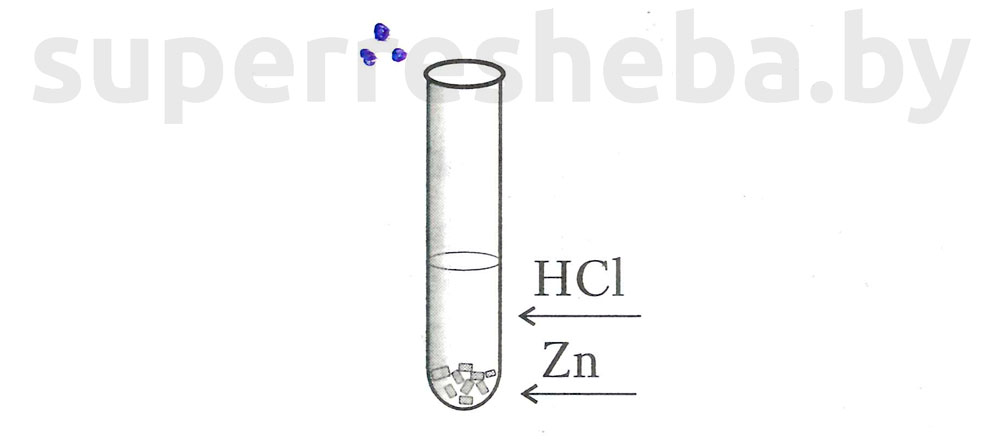
3.
При разбавлении кислоты, скорость реакции уменьшается.
2. Влияние температуры на скорость химической реакции.
2. Сделайте вывод. Скорость химических реакций обычно увеличивается при нагревании, потому что увеличивается число столкновений частиц.