Лаб. 5
1. В пробирки с растворами солей добавьте несколько капель индикаторов или опустите универсальные индикаторные бумажки. Обратите внимание, как изменяется окраска индикатора в каждом растворе, и по окраске определите характер среды растворов предложенных солей. Результаты оформите в таблице.
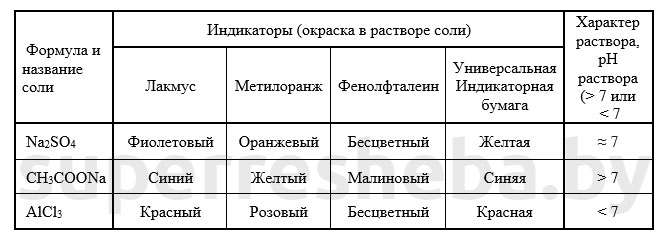
2. Запишите уравнения реакций гидролиза предложенных солей и сделайте вывод о причинах и условиях протекания гидролиза.

Причина гидролиза – электролитическая диссоциация солей и воды. Гидролиз идёт только в том случае, если в составе соли есть остаток слабой кислоты или слабого основания, либо и того, и другого.
3. Задания.
1. Продолжите фразу: «Гидролиз – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц»
2. Приведите примеры двух солей, гидролиз которых протекает по катиону.
и
3. Подчеркните формулы солей, гидролиз которых происходит по аниону:
4. В пробирках 1 и 2 находятся растворы бромида алюминия и карбоната калия. В растворе пробирки 1 лакмус окрашивается в синий цвет. Укажите формулы веществ в пробирках:
1)
2)
5. Запишите формулы веществ, гидролиз которых усиливается в щелочной среде: сульфат меди (II), тристеарат (жир), нитрат калия, сульфид натрия, хлорид железа(III), этилацетат.
Cульфат меди (II), тристеарат (жир), хлорид железа (III), этилацетат.