Лаб. 3
1. Проведите реакцию нейтрализации между соляной кислотой и раствором гидроксида кальция. В присутствии индикатора.
Признаки химической реакции: если в пробирке лакмус, то окраска раствора с красного (из-за HCl) перейдёт в фиолетовый, а метиолоранж с розового на оранжевый.
Ответ:
Вывод:
Сущность реакции в том, что кислота и основание, обмениваясь активными частями, нейтрализуют друг друга.
2. К раствору сульфата меди (II) прибавьте несколько капель раствора гидроксида натрия до появления признаков химической реакции.
В ходе реакции выпадет синий осадок гидроксида меди (II).
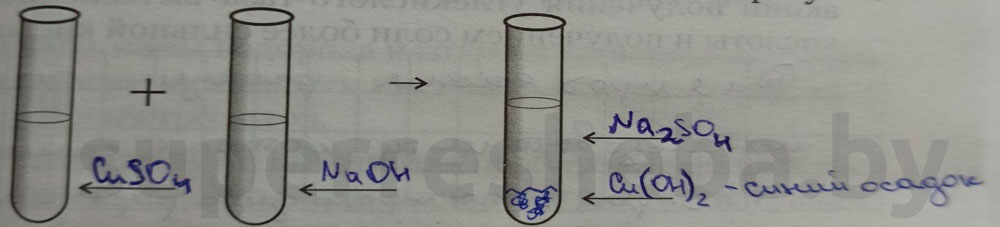
Уравнение реакции в молекулярном, полном и сокращенном ионном виде:
Вывод:
Растворимы в воде соли могут взаимодействовать со щелочами. Реакции обмены, если в результате хотя бы один из продуктов выпадает в осадок.
3. Получите оксид углерода (IV), прибавив к раствору карбоната натрия соляную кислоту.
Признаки химической реакции: выделение газа без цвета и запаха.
Уравнение реакции в молекулярном, полном и сокращенном ионном виде:
Вывод:
Для протекания реакции достаточно использовать кислоту, которая сильнее угольной. Реакция должна протекать в растворе или расплаве.
4. Задания.
1.
• Выделение или поглощение газа
• Выпадение осадка
• Образование воды
• Образование слабого электролита
2.
H+.
3.
S2-, OH-.
4.
г) два нерастворимых вещества»
5.

Вещество Z – BaSO4.