§ 40. Амины
1. Какие органические соединения относятся к: а) аминам; б) первичным аминам?
а) Амины можно рассматривать как производные аммиака, в молекулах которых атомы водорода могут быть замещены на углеводородные группы.
б) Органические соединения, в составе молекул которых содержится аминогруппа $\mathrm{-NH_2},$ связанна с углеводородной группой, называют первичными аминами.
2. Запишите структурные формулы метиламина и этиламина. Укажите функциональную группу
Молекулярные формулы метиламина $\mathrm{CH_5N};$ этиламина $\mathrm{C_2H_7N}.$ Структурные формулы:
$$
\begin{array}{ccc}
\underset{метиламин}{\mathrm{H-\overset{\overset{\huge H}{|}}{\underset{\underset{\huge H}{|}}{C}}-NH_2}} & & \underset{этиламин}{\mathrm{H-\overset{\overset{\huge H}{|}}{\underset{\underset{\huge H}{|}}{C}}-\overset{\overset{\huge H}{|}}{\underset{\underset{\huge H}{|}}{C}}-NH_2}}
\end{array}
$$
Функциональной группой является аминогруппа $\mathrm{-NH_2}.$
3. Сравните формулы двух аминов — метиламина и этиламина — и определите, к какому гомологическому ряду органических соединений и почему можно отнести эти вещества.
Молекулярные формулы метиламина $\mathrm{CH_5N};$ этиламина $\mathrm{C_2H_7N},$ отличаются они друг от друга на группу атомов $\mathrm{CH_2}$ (гомологическая разность). По этой причине метиламин и этиламин являются гомологами гомологического ряда первичных аминов.
4. Можно ли амин, формула которого $\mathrm{CH_3-NH-CH_3}$, отнести к первичным аминам? Ответ поясните
Нет, нельзя. Функциональной группой первичных аминов является $\mathrm{-NH_2}.$
5. Выберите из приведенных формул формулы первичных аминов: $\mathrm{CH_3OH,\, C_3H_7NH_2,\, CH_3NO_2,\, C_6H_5NH_2},$ $\mathrm{C_2H_5COOH,\, C_{17}H_{35}COONa,\, NH_3,\, HCOOH},$ $\mathrm{(CH_3)_2NH,\, C_2H_5NH_2,\, NH_3·H_2O}.$
Формулы первичным аминов: $\mathrm{C_3CH_2CH_2NH_2}$ — пропиламин; $\mathrm{C_6H_5NH_2}$ — анилин; $\mathrm{C_2H_5NH_2}$ — этиламин.
6. На основании какого признака метиламин и этиламин относят к насыщенным аминам, а анилин — к ароматическим?
На основании строения углеводородных групп: в метиламине и этиламине такими группами являются остатки насыщенных углеводородов метана (метил) и этана (этил). анилине таким остатком является фенил $\mathrm{C_6H_5}$ — остаток ароматического углеводорода бензола $\mathrm{C_6H_6}.$
7. Какие из веществ могут реагировать между собой: а) вода, метиламин, анилин; б) этиламин, соляная кислота, магний, анилин? Напишите уравнения соответствующих реакций.
а) $\mathrm{CH_3NH_2+H_2O \leftrightarrow \left[ CH_3NH_3\right]^++OH^-},$
б) $\mathrm{C_2H_5NH_2+HCl \to C_2H_5NH_3Cl}$
$\mathrm{2HCl+Mg \to MgCl_2+H_2\uparrow}$
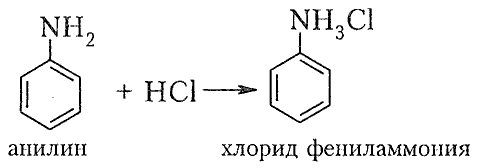
8. Рассчитайте химическое количество метиламина, необходимого для получения хлорида метиламмония массой 54 г.
Дано: $m(метиламмония)=54\,г$
Найти: $n(метиламина)-?$
Решение:
1) Определяем химическое количество метиламмоний хлорида:
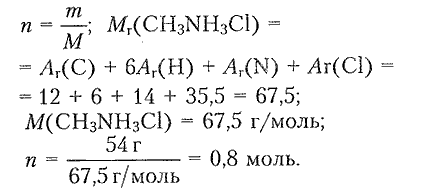
2) Составляем уравнение реакции для определения химического количества метиламина:
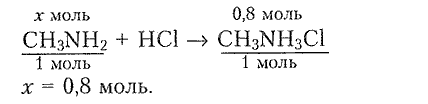
Ответ: $n(метиламина)=0.8\,моль$
9. Рассчитайте объем (н. у.) метиламина, который необходимо пропустить через избыток соляной кислоты, чтобы получить соль массой 261,9 г.
Дано: $m(соли)=261.9\,г$
Найти: $V\mathrm{(CH_3NH_2)}-?$
Решение:
1) Определяем химическое количество:
$\mathrm{СH_3NH_2 + HCl = CH_3NH_3Cl}.\\
M\mathrm{(CH_3NH_3Cl)}=67,5\,г/моль;\\
n\mathrm{(CH_3NH_3Cl)}=\dfrac{261,9}{67,5}=3,88\,моль;\\
n\mathrm{(CH_3NH_2)}=n\mathrm{(CH_3NH_3Cl)}=3,88\,моль.$
2) Определяем объём:
$V_m=22,4\,л/моль;\\
V\mathrm{(CH_3NH_2)}=22,4·3,88=86,9\,л$
Ответ: $V\mathrm{(CH_3NH_2)}=86,9\,л$
10. Соляная кислота с массовой долей хлороводорода 35 % прореагировала в одном случае с анилином массой 31,62 г, а в другом — с этиламином массой 15,30 г. Определите химическое количество солей, образовавшихся в обеих реакциях, и массу затраченной кислоты в каждой реакции. Приведите наиболее краткий путь решения задачи.
Дано:
$\omega\mathrm{(HCl)}=35\% \\ m(анилина)=31.62\,г \\ m(этиламина)=15.30$
Найти:
$n(солей)-? \\ m\mathrm{(HCl)}-?$
Решение:
1) Определим химическое количество солей:
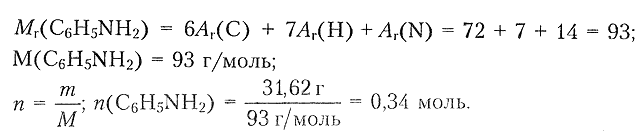
2)
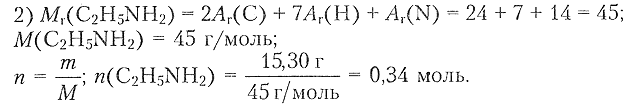
3) Составляем уравнение реакции для одной соли и определяем химическое количество получившейся соли и израсходованной $\mathrm{HCl:}$
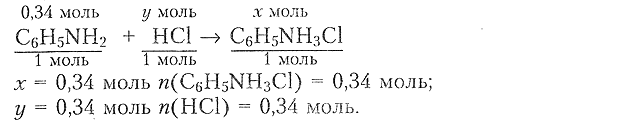
4) Определяем массу кислоты:
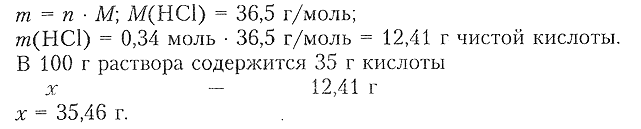
Ответ: $n(солей)=0.34$ моль, масса кислоты на одну соль $=35.46\,г.$