§ 4. Хлороводород. Соляная кислота и хлориды
1. Опишите физические свойства хлороводорода.
Бесцветный газ с резким запахом, несколько тяжелее воздуха, хорошо растворим в воде.
2. Пользуясь данными текста параграфа, рассчитайте растворимость хлороводорода в воде в молях на 1 дм$^3$ воды.
Согласно тексту параграфа в 1 дм$^3$ воды растворяется 500 дм$^3$ хлора.
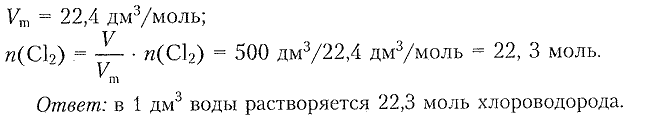
3. Охарактеризуйте химические свойства соляной кислоты. Приведите примеры соответствующих реакций.
Основные реакции:
- $\mathrm{Fe + 2HCl = FeCl_2 + H_2 ↑;}$
- $\mathrm{FeO + 2HCl = FeCl_2 + H2O;}$
- $\mathrm{Ca(OH)_2 + 2HCl = CaCl_2 + 2H_2O;}$
- $\mathrm{K_2CO_3 + 2HCl = 2KCl + H_2O + CO_2 ↑.}$
4. Составьте молекулярные и сокращенные ионные уравнения реакций между соляной кислотой и: а) магнием; б) оксидом кальция; в) гидроксидом алюминия; г) нитратом свинца(II).
Уравнения реакция:
$\mathrm{Mg + 2HCl = MgCl_2 + H_2 ↑;}$
$\mathrm{Mg + 2H^+ = Mg^{+2} + H_2.}$
$\mathrm{CaO + 2HCl = CaCl_2 + H_2O;}$
$\mathrm{CaO + 2H^+ = Ca^{+2} + H_2O.}$
$\mathrm{Al(OH)_3 + 3HCl = AlCl_3 + 3H_2O;}$
$\mathrm{3OH^{-1} + 3H^+ = 3H_2O.}$
$\mathrm{Pb(NO_3)_2 + 2HCl = PbCl_2 + 2HNO_3;}$
$\mathrm{Pb^{+2} + 2Cl^{-1} = PbCl_2.}$
5. Какими опытами можно доказать, что в состав соляной кислоты входят ионы водорода и хлора? Напишите уравнения соответствующих реакций.
- $\mathrm{Zn + HCl = ZnCl_2 + H_2 ↑;}$
- $\mathrm{AgNO_3 + NaCl = AgCl ↓ + NaNO_3.}$
6. Рассчитайте объемы (н. у.) водорода и хлора, необходимые для получения хлороводорода объемом 72,4 дм$^3$.

7. Массовая доля хлороводорода в желудочном соке составляет 3 %. Рассчитайте объем (н. у.) хлороводорода, который потребуется для приготовления такого раствора массой 500 г.

8. В трех пробирках находятся водные растворы: а) хлора; б) хлорида натрия; в) нитрата серебра(I). Как их различить?
- В каждую пробирку добавить раствор иодида калия KI. Ничего не произойдёт в пробирке, содержащей раствор хлорида натрия.
- В пробирке с раствором нитрата серебра (I) образуется осадок: $\mathrm{AgNO_3 + KI = KNO_3 + AgI ↓.}$
- В пробирке с раствором хлора образуется иод и раствор покраснеет: $\mathrm{Cl_2 + 2KI = 2KCl + I_2.}$
9. Рассчитайте массу соляной кислоты с массовой долей $\mathrm{HCl}$ $15 \%,$ необходимой для нейтрализации раствора, содержащего $\mathrm{NaOH}$ массой 100 г. Вычислите химическое количество хлороводорода, который содержится в указанном растворе.

10. Составьте уравнения реакций, которые необходимо провести, чтобы осуществить превращения:
а) $\mathrm{H_2 → HCI → Cl_2 → PCl_3;}$
б) $\mathrm{NaCI → ? → KCI → ? → HCI;}$
в) $\mathrm{Cl_2 → HCI → CuCI_2 → FeCI_2 → AgCI.}$
а) $\mathrm{H_2 + Cl_2 = 2HCl;}$
$\mathrm{4HCl + MnO_2 = MnCl_2 + Cl_2 + Cl_2 + 2H_2O;}$
$\mathrm{2P + 3Cl_2 = 2PCl_3.}$
б) $\mathrm{2NaCl + H_2SO_4 = Na_2SO_4 + 2HCl ↑;}$
$\mathrm{HСl + KOH = H_2O + KCl;}$
$\mathrm{2KCl + Pb(NO_3)_2 = 2KNO_3 + PbCl_2;}$
$\mathrm{PbCl_2 + H2SO_4 = PbSO_4 + 2HCl ↑.}$
в) $\mathrm{Cl_2 + H_2 = 2HCl;}$
$\mathrm{2HCl + Cu(OH)_2 = CuCl_2 + 2H_2O;}$
$\mathrm{CuCl_2 + Fe = FeCl_2 + Cu;}$
$\mathrm{FeCl_2 + 2AgNO_3 = Fe(NO_3)_2 + 2AgCl ↓.}$