§ 3. Галогены — элементы VIIA-группы
1. Чем сходны по строению и чем отличаются следующие частицы: a) $\mathrm{Cl^0}$ и $\mathrm{Cl^-;}$ б) $\mathrm{Cl^0}$ и $\mathrm{Br^0;}$ в) $\mathrm{F^0}$ и $\mathrm{Ne^0?}$
- a) $\mathrm{Cl^0}$ (7 электронов) и $\mathrm{Cl^-}$ (8 электронов) — имеют одинаковый заряд ядра (+17); отличаются числом электронов на внешнем слое.
- б) $\mathrm{Cl^0}$ и $\mathrm{Br^0}$ — сходны по строению: у обоих на внешнем электронном слое находится 7 электронов; отличаются: у брома большой заряд ядра и большее число электронных слоёв.
- в) $\mathrm{F^0}$ и $\mathrm{Ne^0}$ — отличаются числом электронов на внешнем электронном слое, у фтора — 7 электронов; у неона — 8 электронов (завершённый слой).
2. Сколько всего электронов содержится в молекуле брома? Сколько общих электронных пар участвует в образовании химической связи?
В молекуле брома 70 электронов; в образовании химической связи участвует одна общая электронная пара.
3. Какой объем при н. у. занимает хлор химическим количеством 4 моль? Сколько молекул хлора находится в этом объеме?
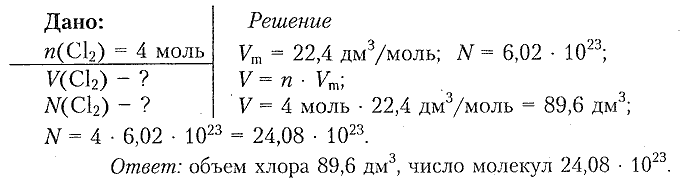
4. Определите степени окисления галогенов в следующих соединениях: $\mathrm{HF,}$ $\mathrm{OF_2,}$ $\mathrm{NCl_3,}$ $\mathrm{KClO_3,}$ $\mathrm{NaBrO_4,}$ $\mathrm{H_5IO_6.}$
Степени окисления: $\mathrm{HF^{-1},}$ $\mathrm{OF_2^{-1},}$ $\mathrm{NCl_3,}$ $\mathrm{KCl^{+5}O_3,}$ $\mathrm{NaBr^{+7}O_4,}$ $\mathrm{H_5I^{+7}O_6.}$
5. Почему простые вещества галогены являются окислителями? Приведите по 1-2 примера химических реакций, иллюстрирующих окислительные свойства галогенов.
Галогены являются окислителями потому, что на внешнем электронном слое находится семь электронов и до завершения этого слоя (8 электронов) не хватает одного электрона.
- $\mathrm{Mg + Cl_2}$ (окислитель) $\mathrm{= MgCl_2;}$
- $\mathrm{Cl_2}$ (окислитель) $\mathrm{+ 2NaBr = Br_2 + 2NaCl.}$
6. При нагревании алюминия в токе хлора был получен хлорид алюминия массой 26,7 г. Рассчитайте химическое количество хлора, который вступил в реакцию.

7. Можно ли вывести пятно иода на ткани, обработав его раствором поваренной соли? Почему?
Нельзя: каждый галоген в виде простого вещества способен окислять (вытеснять) только ионы нижестоящих в группе галогенов, а иод в периодической системе стоит ниже хлора.
8. Рассчитайте объем (н. у.) хлора, который необходим для полного вытеснения всего иода из раствора иодида калия объемом 200 см$^3$ (плотность раствора 1,23 г/см$^3$) и массовой долей соли, равной 25,6 %.

9. Составьте уравнения реакций, иллюстрирующих следующие превращения: $\mathrm{NaI → NaBr → Br_2 → FeBr_3.}$ Укажите в каждой реакции окислитель и восстановитель.
Уравнение реакций:
- $\mathrm{Br_2 + 2NaI = I_2 + 2NaBr,}$ (окислитель — молекула брома);
- $\mathrm{Cl_2 + 2NaBr = 2NaCl + Br_2}$ (окислитель — молекула хлора);
- $\mathrm{2Fe + 3Br_2 + 2FeBr_3}$ (окислитель — молекула брома).