§ 1. Общая характеристика неметаллов
1. Рассмотрите положение неметаллов в периодической системе химических элементов. Можно ли провести точную границу между металлами и неметаллами?
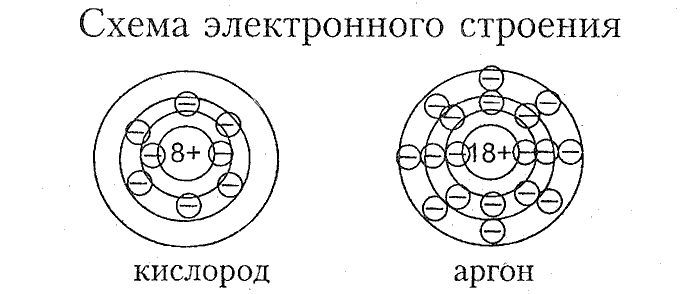
Неметаллы в периодической таблице располагаются в правой части таблицы правее бора и граница между металлами и неметаллами проходит по ступенчатой линии от бора B к элементу с атомным номером 118.
2. Составьте электронные схемы атомов кислорода и аргона.
3. Какие степени окисления могут проявлять неметаллы в своих соединениях? Определите степень окисления хлора в соединениях: $\mathrm{KCI}$, $\mathrm{Cl_2O_7}$, $\mathrm{KClO_3}$; азота — в соединениях: $\mathrm{NH_3}$, $\mathrm{N_2O}$, $\mathrm{KNO_3}$.
В своих соединениях неметаллы проявляют как отрицательную, так и положительную степень окисления.
Степени окисления хлора:
$$\mathrm{K\overset{-1}{Cl}; \overset{+7}{CL_2}O_7; K\overset{+5}{Cl}O_3.}$$
Степени окисления азота:
$$\mathrm{\overset{-3}{N}H_3; \overset{+1}{N_3}O; K\overset{+5}{N}O_3.}$$
4. Определите степени окисления атомов неметаллов в указанных соединениях: $\mathrm{AlBr_3,}$ $\mathrm{Na_2O,}$ $\mathrm{Mgl_2,}$ $\mathrm{P_2O_5,}$ $\mathrm{H_2Se,}$ $\mathrm{SF_6,}$ $\mathrm{PCI_3,}$ $\mathrm{CaH_2.}$
Степени окисления:
$\mathrm{Al\overset{-1}{Br_3};}$ $\mathrm{Na_2\overset{-2}{O};}$ $\mathrm{Mg\overset{-1}{l_2};}$ $\mathrm{\overset{+5}{P_2}\overset{-2}{O_5};}$ $\mathrm{\overset{+1}{H_2}\overset{-2}{Se};}$ $\mathrm{\overset{+6}{S}\overset{-1}{F_6};}$ $\mathrm{\overset{+3}{P}\overset{-1}{CI_3};}$ $\mathrm{Ca\overset{-1}{H_2}.}$
5. Укажите максимальную положительную и минимальную отрицательную степени окисления следующих неметаллов: $\mathrm{P,}$ $\mathrm{Se,}$ $\mathrm{Br.}$ Составьте формулы кислородных и водородных соединений неметаллов в этих степенях окисления.
Максимальная положительная степень окисления фосфора $\mathrm{+6;}$ селена $\mathrm{+6;}$ брома $\mathrm{+7.}$ Минимальная отрицательная степень окисления фосфора $\mathrm{-3;}$ селена $\mathrm{-2;}$ брома $\mathrm{-1.}$ Кислородные соединения: $\mathrm{P_2O_5;}$ $\mathrm{SeO_3;}$ $\mathrm{Br_2O_7.}$ Водородные соединения: $\mathrm{PH_3;}$ $\mathrm{H_2Se;}$ $\mathrm{HBr}$.
6. Какие из неметаллов чаще всего встречаются: а) во Вселенной; б) в земной коре; в) в живых организмах?
а) Во вселенной чаще встречаются неметаллы водород $\mathrm{H}$ и гелий $\mathrm{He;}$
б) в земной коре — кислород ($49\%$) и кремний ($28\%$);
в) в живых организмах — элементы-органогены: углерод $\mathrm{C,}$ водород $\mathrm{H,}$ азот $\mathrm{N,}$ фосфор $\mathrm{P}$ и сера $\mathrm{S.}$
7. В виде каких соединений неметаллы входят в состав минералов и горных пород?
Неметаллы входят в состав минералов и горных пород в виде оксидов (например, $\mathrm{SiO_2, Fe_2O_3}$), Сульфидов (например, $\mathrm{ZnS, FeS_2}$ и др.), хлоридов (например, $\mathrm{KCl, NaCl}$ и пр) и солей — сульфатов, силикатов; карбонатов и фосфатов).
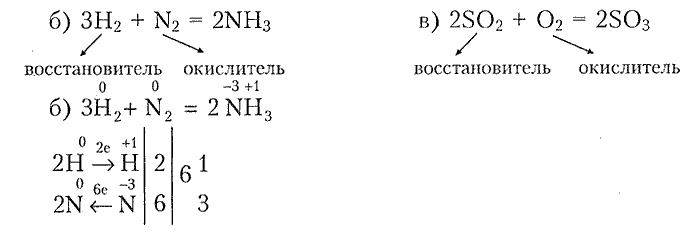
8. Среди приведенных уравнений выберите уравнения окислительно-восстановительных реакций, укажите окислитель и восстановитель, а также составьте схемы перехода электронов от восстановителя к окислителю:
а) $\mathrm{CaO + СO_2 = CaCO_3;}$
б) $\mathrm{3H_2 + N_2 = 2NH_3;}$
в) $\mathrm{2SO_2 + O_2 = 2SO_3.}$
9. Рассчитайте массу воды, образующейся при взрыве смеси водорода массой 2 г и кислорода массой 12 г.
Дано:
$m(\mathrm{H_2})=2\,г$
$m(\mathrm{O_2})=12\,г$
$m(\mathrm{H_2O})-?$
Решение:
$M(\mathrm{H_2})=2$ г/моль; $M(\mathrm{O_2})=32$ г/моль; $M(\mathrm{H_2O})=18$ г/моль.
Рассчитаем химические количества реагентов:
$m(\mathrm{H_2})=\dfrac{m}{M};$ $n=\dfrac{2\,г}{2\,г/моль}=1\,моль;$
$n(\mathrm{O_2})=\dfrac{12\,г}{32\,г/моль}=0.375\,моль.$
Записываем уравнение реакции:
$$\overset{1\,моль}{\underset{2\,моль}{2H_2}} + \overset{x\,моль}{\underset{1\,моль}{O_2}} → 2H_2O$$
$\dfrac{1}{2}=\dfrac{x}{1}; x=0.5\,моль.$
Из уравнения реакции видно, что на 1 моль водорода требуется $\frac{1\,моль · 1\,моль}{2\,моль}=0.5$ моль кислорода.
Следовательно, расчёт ведём по кислороду:
$2H_2+\dfrac{\overset{0.375\,моль}{O_2}}{1\,моль}→\dfrac{\overset{x\,моль}{2H_2O}}{2\,моль}$
$x=0.75$ моль.
Масса воды $m=n·M(\mathrm{H_2O});$ $m=0.75\,моль · 18\,г/моль=13.5\,г/$
Ответ: $13.5$ г.