§ 46. Основные понятия химии
1. Дайте определение понятия «химический элемент». Чем отличается это понятие от понятия «простое вещество»?
Химический элемент — вид атомов или ионов с одинаковым положительным зарядом ядра. Понятие «простое вещество» относится к соединению, для которого характерны определённые физические и химические свойства.
2. Вспомните, какие типы сложных неорганических веществ вам известны. Напишите схему их взаимопревращений на примере соединений бария и серы.
Сложные вещества — кислоты, основания, оксиды, соли.
$\mathrm{2Ba+O_2\to 2BaO \\
BaO+H_2O\to Ba(OH)_2 \\
Ba(OH)_2+2HCl\to BaCl_2+2H_2O}$
$\mathrm{S+O\to SO_2 \\
2SO_2+O_2\to 2SO_3 \\
SO_3+H_2O\to H_2SO_4 \\
MgO+H_2SO_4\to MgSO_4+H_2O}$
3. Запишите уравнения реакций, которые необходимо провести, чтобы осуществить превращения.
а) $\mathrm{2P+5O_2=2P_2O_5 \\
P_2O_5+3H_2O=2H_3PO_4 \\
H_3PO_4+3KOH=K_3PO_4+3H_2O \\
2K_3PO_4+3CaCl_2=Ca_3(PO_4)_2+6KCl \\
Ca_3(PO_4)_2+3H_2SO_4=3CaSO_4+2H_3PO_4}$
б) $\mathrm{2CuO+H_2SO_4=CuSO_4+H_2O \\
CuSO_4+2NaOH=Cu(OH)_2+Na_2SO_4 \\
Cu(OH)_2+2HCl=CuCl_2+2H_2O \\
CuCl_2+Fe=Cu+FeCl_2}$
4. Охарактеризуйте количественно согласно схеме на рисунке 154: а) порцию безводной серной кислоты массой 24,5 г и плотностью 1,84 г/см$^3;$ б) порцию карбоната кальция химическим количеством 0,5 моль и плотностью 2,8 г/см$^3.$
а) $M\mathrm{(H_2SO_4)}=98$ г/моль;
$n=\dfrac{m}{M};$ $n\mathrm{(H_2SO_4)}=0.25$ моль $(24.5:98);$
$V=\dfrac{m}{ρ}; \\ V\mathrm{H_2SO_4)}=13.3\, дм^3.$
б) $M\mathrm{(CaCO_3)}=100$ г/моль;
$m\mathrm{(CaCO_3)}=50$ г;
$V\mathrm{(CaCO_3)}=17.9\,см^3.$
5. Приведите по 2 примера реакций: а) соединения; б) разложения; в) замещения; г) обмена. Какие из них являются окислительно-восстановительными? В этих реакциях укажите вещество окислитель и вещество восстановитель.
а) реакции соединения $\mathrm{CaO+H_2O=Ca(OH)_2}$
$\mathrm{\underset{восстановитель}{2H_2}+\underset{окислитель}{O_2}=2H_2O}$
б) реакции разложения $\mathrm{CaCO_3=CaO+CO_2\uparrow}$
$\mathrm{NH_4Cl=NH_3+HCl}$
в) реакции замещения
$\mathrm{\underset{восстановитель}{Zn}+\underset{окислитель}{2HCl}=ZnCl_2+H_2\uparrow}$
$\mathrm{\underset{окислитель}{CuO}+\underset{восстановитель}{H_2}=Cu+H_2O}$
г) реакции обмена $\mathrm{KOH+HCl=KCl+H_2O}$
$\mathrm{BaCl_2+Na_2SO_4=BaSO_4\downarrow +2NaCl}$
6. Определите химическое количество сульфида алюминия, полученного при взаимодействии алюминия массой 6,3 г с серой. Рассчитайте массовую долю металла в сульфиде.
Дано: $m\mathrm{(Al)}=6.3$ г.
Найти:
$n\mathrm{(Al_2S_3)}-? \\ \omega\mathrm{(Al)}-?$
Решение:
1) Определяем химическое количество алюминия:
$\mathrm{n=\dfrac{m}{M}};\, M\mathrm{(Al)}=27\,г/моль;$
$n\mathrm{(Al)}=\dfrac{6.3\,г}{27\,г/моль}=0.233\, моль.$
2) Составляем уравнение реакции для определения химического количества сульфида алюминия:
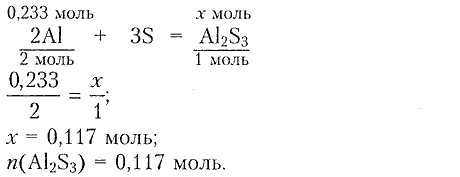
3) Определяем массовую долю алюминия:
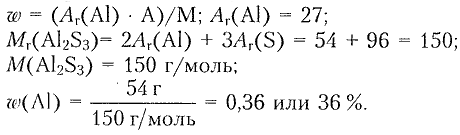
Ответ: $n\mathrm{(Al_2S_3)}=0.115\, моль; \omega\mathrm{(Al)}=36\%.$
7. При прокаливании карбоната кальция получили углекислый газ массой 40 г. Рассчитайте массу и химическое количество карбоната кальция, взятого для реакции.
Дано: $m\mathrm{(CO_2)}=40$ г
Найти:
$n\mathrm{(CaCO_3)}-? \\ m\mathrm{(CaCO_3)}-?$
Решение:
1) Определяем химическое количество $\mathrm{CO_2}:$
$n=\dfrac{m}{M};$
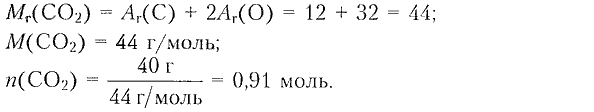
2) Составляем уравнение реакции для определения химического количества карбоната кальция:
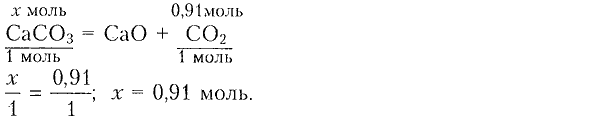
3) Определяем массу карбоната кальция:
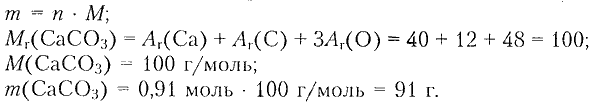
Ответ: $n\mathrm{(CaCO_3)}=0.91\,моль; m\mathrm{(CaCO_3)}=91\,г.$
8. При взаимодействии цинка с соляной кислотой, массовая доля $\mathrm{HCl}$ в которой равна 22 %, выделился газ объемом (н. у.) 11,2 дм$^3.$ Рассчитайте массу раствора кислоты, затраченного на реакцию.
Дано:
$\omega\mathrm{(HCl)}=22\% \\ V\mathrm{(H_2)}=11.2\,дм^3 $
Найти: $m(раствора\,кислоты)-?$
Решение:
1) Определяем химическое количество водорода:
$n=\dfrac{V}{V_m};$ $V_m=22.4\,дм^3/моль;$
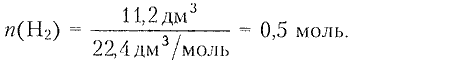
2) Составляему равнение реакции для определения химического количества и массы кислоты:
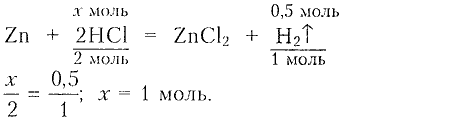
3) Определяем массу кислоты:

Ответ: $m(раствора\,кислоты) = 165.9\,г$
9. В результате взаимодействия раствора соли бария с раствором серной кислоты образовался осадок химическим количеством 0,5 моль. Определите массу соли бария, вступившей в реакцию, если это: а) хлорид бария; б) нитрат бария.
Дано:
а) $\mathrm{BaCl_2}$
$n\mathrm{(BaSO_4)}=0.5$ моль
Найти: $m\mathrm{(BaCl_2)}-?$
Решение:
1) Составляем уравнение реакции для определения химического количества соли:
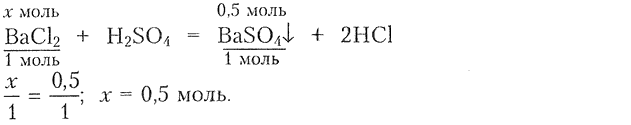
3) Определяем массу соли:
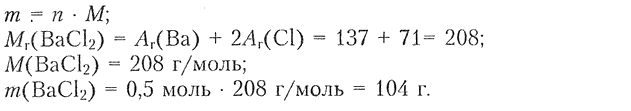
б) $\mathrm{(Ba(NO_3)_2}$ Решение
1) Составлем уравнение реакции для определения химического количества соли:
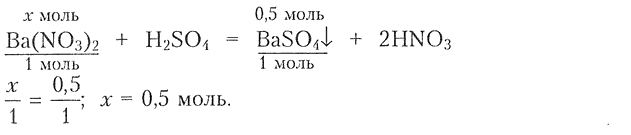
2) Определяем массу соли:
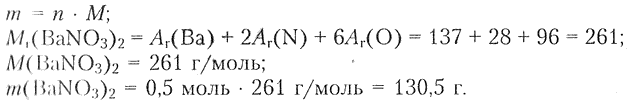
Ответ: а) масса = 104 г; б) масса = 130.5 г.