§ 5. Галогены в природе. Биологическое значение и применение галогенов и их соединений
1. Почему в природе не встречаются галогены в форме простых веществ? Назовите основные природные источники для получения галогенов.
Галогены в форме простых веществ в природе не встречаются из-за их высокой химической активности. Источники хлора — галит (каменная, или поваренная соль) $\mathrm{NaCl;}$ фтора — плавниковый шпат $\mathrm{CaF_2.}$
2. В виде каких соединений хлор встречается в природе?
Хлор встречается в природе в виде:
а) галита ($\mathrm{NaCl}$),
б) сильвина ($\mathrm{KCl}$),
в) сильвинита ($\mathrm{NaCl, KCl}$),
г) карналлита ($\mathrm{KCl, MgCl_2, 6H_2O}$).
3. Расскажите о биологической значимости каждого из галогенов.
Биологическое значение соединений фтора: без фтора невозможно правильное развитие костного скелета и зубов.
Биологическое значение соединений хлора: поддерживает нормальную деятельность клеток, источник соляной кислоты в желудке человека.
Биологическое значение соединений брома: участвует в урегулировании процессов центральной нервной системы.
Биологическое значение соединений иода: недостаток иода в пище снижает выработку гормона щитовидной железы.
4. Для чего иодируют и фторируют поваренную соль?
При недостатке фтора происходит поражение зубной ткани, развивается кариес. Иод способствует выработке гормона щитовидной железы. Недостаток этого гормона приводит к «зобной болезни». По этим причинам иодируют и фторируют пищевую поваренную соль.
5. Рассчитайте массу простого вещества фтора, который можно получить из минерала флюорита массой 160 г.

6. В водном растворе массой 120 г содержится $\mathrm{CaCl_2}$ химическим количеством 0,1 моль. Определите массовую долю ионов хлора в этом растворе.

7. Составьте уравнения реакций, иллюстрирующих следующие превращения:
а) $\mathrm{Kl → I_2 → Agl;}$
б) $\mathrm{Cl2 → NaCI → HCI.}$
а) $\mathrm{Cl_2 + 2KI = 2KCl + I_2,}$
$\mathrm{I_2 + 2Ag = 2AgI;}$
б) $\mathrm{Cl_2 + 2Na = 2NaCl,}$
$\mathrm{NaCl + H_2SO_4 = NaHSO_4 + HCl;}$
8. Рассчитайте массу иода, необходимого для приготовления йодной настойки массой 560 г, если массовая доля вещества в растворе составляет 0,08.
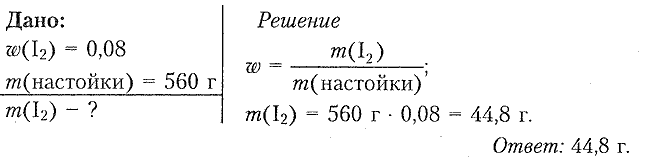
9. В пивоварении пользуются плавиковой кислотой $\mathrm{HF}$ для уничтожения бактерий молочнокислого, уксуснокислого и других нежелательных для основного процесса видов брожения. При добавлении раствора плавиковой кислоты массой 10 г с массовой долей $\mathrm{HF,}$ равной 30 %, к сбраживаемой жидкости объемом 100 дм$^3$ эти бактерии погибают, а бактерии спиртового брожения сохраняются. Рассчитайте массовую долю $\mathrm{HF}$ в сбраживаемой жидкости, приняв плотность последней равной 1 г/см$^3.$
